Elektrivoolu kandjad
Elektrit defineeritakse tänapäeval tavaliselt kui "elektrilaenguid ja nendega seotud elektromagnetvälju". Elektrilaengute olemasolu näitab nende tugev mõju teistele laengutele. Iga laengu ümber oleval ruumil on erilised omadused: selles toimivad elektrilised jõud, mis avalduvad siis, kui sellesse ruumi tuuakse teisi laenguid. See on selline ruum jõuline elektriväli.
Kui laengud on paigal, on nendevahelisel ruumil omadused elektriline (elektrostaatiline) väli… Aga kui laengud liiguvad, siis on neid ka nende ümber magnetväli… Me käsitleme elektri- ja magnetvälja omadusi eraldi, kuid tegelikult on elektrilised protsessid alati seotud olemasoluga elektromagnetväli.

Väiksemad elektrilaengud sisalduvad komponentidena aatom... Aatom on keemilise elemendi väikseim osa, mis kannab selle keemilisi omadusi. Aatom on väga keeruline süsteem. Suurem osa selle massist on koondunud tuumasse. Elektriliselt laetud elementaarosakesed tiirlevad viimaste ümber teatud orbiitidel — elektronid.
Gravitatsioonijõud hoiavad planeete ümber Päikese orbiitidel liikumas ja elektronid tõmbavad aatomi tuumasse elektrijõudude abil. Kogemusest on teada, et ainult vastandlikud laengud tõmbavad üksteist. Seetõttu peavad aatomi tuuma ja elektronide laengud olema märgi poolest erinevad. Ajaloolistel põhjustel on tavaks pidada tuuma laengut positiivseks ja elektronide laenguid negatiivseks.
Arvukad katsed on näidanud, et iga elemendi aatomite elektronidel on sama elektrilaeng ja sama mass. Samas on elektrooniline laeng elementaarne ehk väikseim võimalik elektrilaeng.
On tavaks teha vahet elektronide vahel, mis paiknevad aatomi sise- ja välisorbiitidel. Sisemised elektronid on oma orbiidil suhteliselt tugevalt hoitud aatomisisese jõudude poolt. Kuid välised elektronid võivad aatomist suhteliselt kergesti eralduda ja jääda mõnda aega vabaks või kinnituda mõne teise aatomi külge. Aatomi keemilised ja elektrilised omadused määravad selle välistel orbiitidel olevad elektronid.
Aatomi tuuma positiivse laengu suurus määrab, kas aatom kuulub teatud keemilise elemendi hulka. Aatom (või molekul) on elektriliselt neutraalne seni, kuni elektronide negatiivsete laengute summa võrdub tuuma positiivse laenguga. Kuid aatom, mis on kaotanud ühe või mitu elektroni, saab positiivselt laetud tuuma liigse positiivse laengu tõttu. See võib liikuda elektriliste jõudude (atraktiivsete või tõrjuvate) mõjul. Selline aatom on positiivne ioon… Aatom, mis on hõivanud liigsed elektronid, muutub negatiivne ioon.
Positiivne laengukandja aatomi tuumas on prooton… See on elementaarosake, mis toimib vesinikuaatomi tuumana. Prootoni positiivne laeng on arvuliselt võrdne elektroni negatiivse laenguga, kuid prootoni mass on 1836 korda suurem elektroni massist. Aatomite tuumad sisaldavad lisaks prootonitele ka neutroneid — osakesi, millel puudub elektrilaeng. Neutroni mass on 1838 korda suurem elektroni massist.
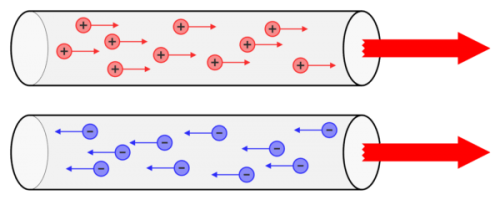
Seega kolmest aatomit moodustavast elementaarosakesest on elektrilaengud ainult elektronil ja prootonil, kuid neist ainult negatiivselt laetud elektronid saavad aine sees kergesti liikuda ja positiivsed laengud saavad normaalsetes tingimustes liikuda ainult aatomis. raskete ioonide vorm, st aine aatomite ülekandmine.
Moodustub elektrilaengute järjestatud liikumine ehk liikumine, millel on ruumis valdav suund elektrit… Osakesed, mille liikumine tekitab elektrivoolu – voolukandjad on enamasti elektronid ja palju harvem ioonid.
Võttes arvesse mõningast ebatäpsust, on võimalik voolu määratleda kui elektrilaengute suunatud liikumist. Voolukandjad võivad aines enam-vähem vabalt liikuda.
Juhtmetest nimetatakse aineteks, mis juhivad suhteliselt hästi voolu. Kõik metallid on juhid, eriti hõbe, vask ja alumiinium.
Metallide juhtivus on seletatav asjaoluga, et neis on osa väliseid elektrone aatomitest eraldatud. Nende elektronide kadumisest tulenevad positiivsed katsed on ühendatud kristallvõre - tahke (ioonse) skeletiga, mille ruumides on vabad elektronid teatud tüüpi elektrongaasi kujul.
Väikseim väline elektriväli tekitab metallis voolu ehk sunnib vabu elektrone segunema neile mõjuvate elektrijõudude suunas. Metalle iseloomustab juhtivuse vähenemine temperatuuri tõustes.
Pooljuhid juhivad elektrivoolu palju halvemini kui juhtmed. Väga suur hulk aineid kuulub pooljuhtide hulka ja nende omadused on väga mitmekesised. Pooljuhtidele on iseloomulik elektrooniline juhtivus (see tähendab, et neis olev vool tekib, nagu metallides, vabade elektronide, mitte ioonide suunatud liikumisel) ja erinevalt metallidest juhtivuse suurenemine temperatuuri tõustes. Üldiselt iseloomustab pooljuhte ka nende juhtivuse tugev sõltuvus välismõjudest — kiirgusest, rõhust jne.
Dielektrikud (isolaatorid) nad praktiliselt ei juhi voolu. Väline elektriväli põhjustab ndielektrikute aatomite, molekulide või ioonide polarisatsioonaatomi või dielektrilise molekuli moodustavate elastselt seotud laengute nihkumine välisvälja toimel. Vabade elektronide arv dielektrikutes on väga väike.
Te ei saa määrata kõvasid piire juhtide, pooljuhtide ja dielektrikute vahel. Elektriseadmetes toimivad juhtmed elektrilaengute liikumise teekonnana ja selle liikumise õigeks suunamiseks on vaja dielektrikuid.
Elektrivool tekib mitteelektrostaatilist päritolu jõudude, mida nimetatakse välisjõududeks, mõjul laengutele.Need tekitavad juhtmes elektrivälja, mis sunnib positiivseid laenguid liikuma väljajõudude suunas ja negatiivseid laenguid, elektrone, vastupidises suunas.
Kasulik on selgitada elektronide translatsioonilise liikumise mõistet metallides. Vabad elektronid on aatomitevahelises ruumis juhusliku liikumise olekus, molekulide vastupidises termilises liikumises. Keha termilise seisundi põhjustavad molekulide kokkupõrked üksteisega ja elektronide kokkupõrked molekulidega.
Elektron põrkab kokku molekulidega ja muudab oma liikumise suunda, kuid jätkab järk-järgult edasiliikumist, kirjeldades väga keerulist kõverat. Laetud osakeste pikaajalist liikumist ühes kindlas suunas, mis kattub nende kaootilise liikumisega eri suundades, nimetatakse nende triiviks. Seega on metallides olev elektrivool tänapäevaste vaadete kohaselt laetud osakeste triiv.